
Яков Борисович Миркин. Врач-уролог отделения восстановительного лечения ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России.
«Урология сегодня» № 6 (22) 2012
Внутрипузырная терапия хронического цистита вообще и бактериального в частности давно привлекает внимание урологов, как в России, так и за рубежом.
Действительно, у местной терапии есть преимущества:
- Возможность создать достаточно высокую концентрацию препарата в месте введения.
- Минимизация системных побочных эффектов.
- Обеспечение комплаенса, поскольку процедуры обычно проводит лечащий врач.
- Некоторые препараты вообще невозможно ввести иным путем (ботулинический токсин, резинифератоксин, гиалуроновая кислота, диоксидин, димексид и пр.).
Однако есть и недостатки:
- Отсутствие стандартов внутрипузырной терапии.
- Необходимость регулярной катетеризации в процессе лечения.
- Недостаточное время воздействия.
За рубежом в основном применяются смеси глюкокортикоидов, анестетиков и протекторов уротелия (гепарин, гиалуронат натрия). Например, R. Moldwin рекомендует коктейль из 20 мл 0,5 % маркаина, 20 мл 2 % лидокаина, 10 000 ЕД гепарина, 40 мг триамцинолона и 80 мг гентамицина.
Видимо, урологическому сообществу еще предстоит разработать методические рекомендации для внутрипузырной терапии. Возможно, имеет смысл создать рабочую группу или экспертный совет.
А пока, давайте попробуем разобраться в основных целях и принципах внутрипузырной терапии хронического бактериального цистита.
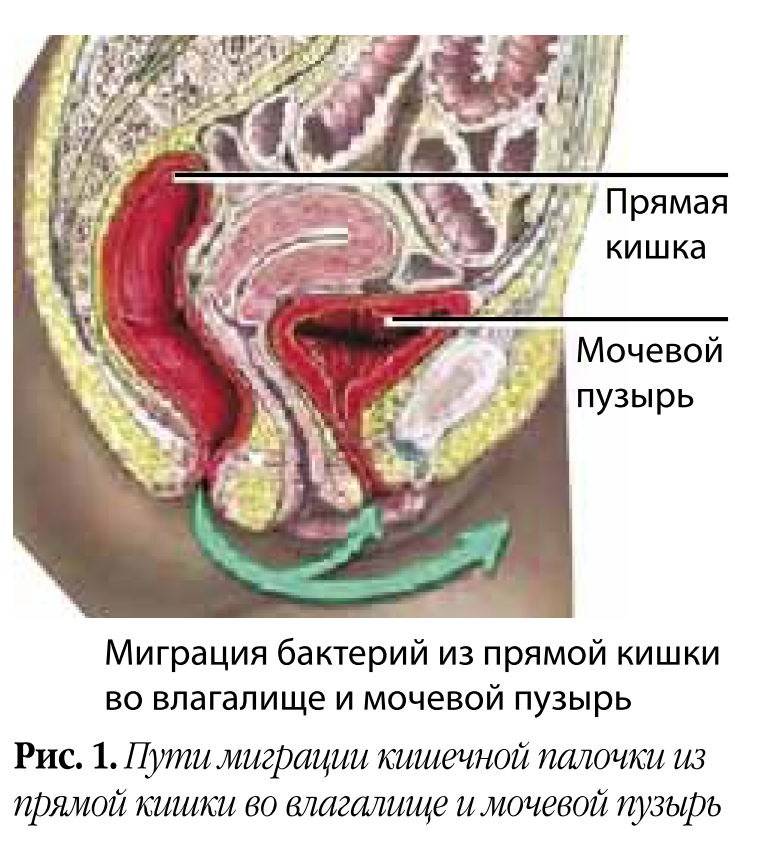 Во-первых, это патогенетическая терапия. Основным возбудителем цистита до недавнего времени считалась E. coli (рис. 1), точнее ее уропатогенные штаммы, обладающие инструментами вирулентности: гиалуронидазой для разрушения гликозаминогликанового слоя мочевого пузыря и фимбриями для прикрепления к уротелию.
Во-первых, это патогенетическая терапия. Основным возбудителем цистита до недавнего времени считалась E. coli (рис. 1), точнее ее уропатогенные штаммы, обладающие инструментами вирулентности: гиалуронидазой для разрушения гликозаминогликанового слоя мочевого пузыря и фимбриями для прикрепления к уротелию.
Перорального применения фторхинолонов было вполне достаточно для ее элиминации. Однако, в последнее время доказана возможность образования микробных ассоциаций в уротелии, защищенных биопленками. Такие микроколонии могут содержать несколько десятков видов микроорганизмов (в том числе анаэробов) с разделением функций. Проникновение в них антибиотиков при системном применении затруднено (рис. 2).

Таким образом, потенциальный препарат для внутрипузырной антибактериальной терапии должен обладать широким спектром действия, проникать в уротелий и микроколонии.
Во-вторых, необходимо в короткие сроки купировать болевой синдром и поллакиурию. Для этого можно использовать местные анестетики (лидокаин, маркаин) или М-холинолитики.
В-третьих, представляется целесообразным сформировать местный иммунитет.
В четвертых, необходимо восстановить поврежденный уротелий.
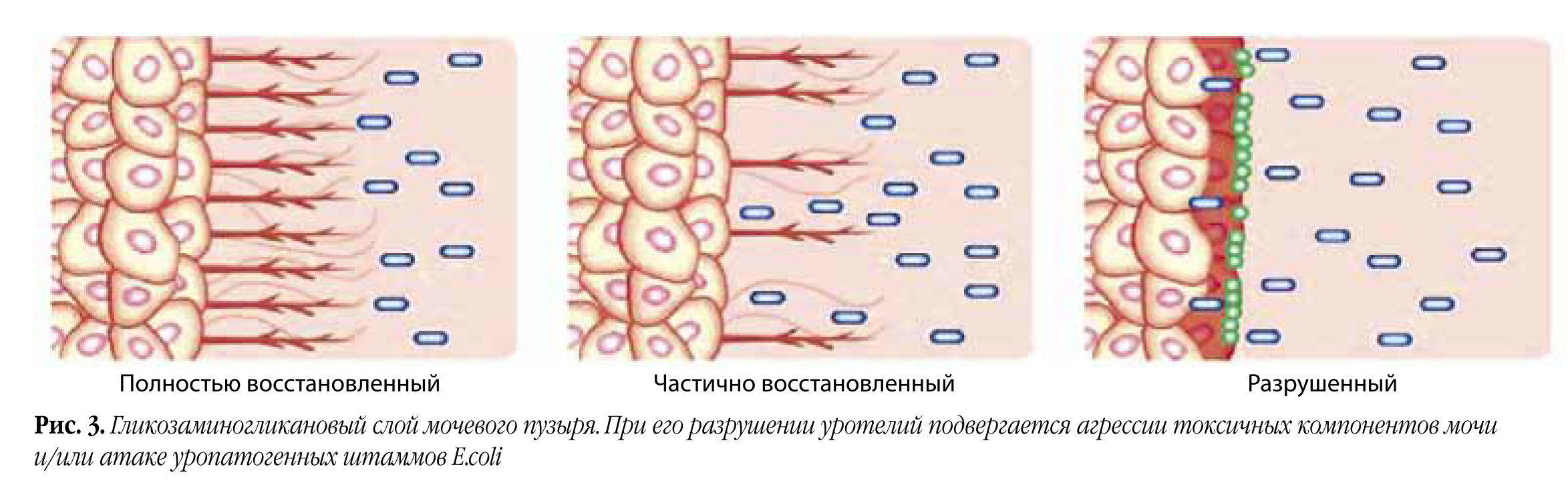
И наконец, в пятых – восстановить гликозаминогликановый слой мочевого пузыря, препятствующий адгезии бактерий (рис. 3).
Одним из главных недостатков внутрипузырной терапии является слабая адгезия препаратов к уротелию. То есть, они выводятся из мочевого пузыря вскоре после введения. Следовательно, необходимо обеспечить длительную адгезию, минимум 24 ч. Понятно, что такое продолжительное воздействие должен обеспечивать целый комплекс препаратов. Однако, фармакохимическое взаимодействие в таком «коктейле» достаточно трудно спрогнозировать и оценить. Кроме того, на разных этапах терапии требуется различное воздействие, которое, кстати, зависит еще и от динамики патологического процесса.
Поэтому совместно с группой биохимиков, которую возглавляет проф. Н.Д. Олтаржевская, мы решили разработать комплекс препаратов для внутрипузырной терапии хронического бактериального цистита.
В основу легла концепция 3 этапов терапии цистита.
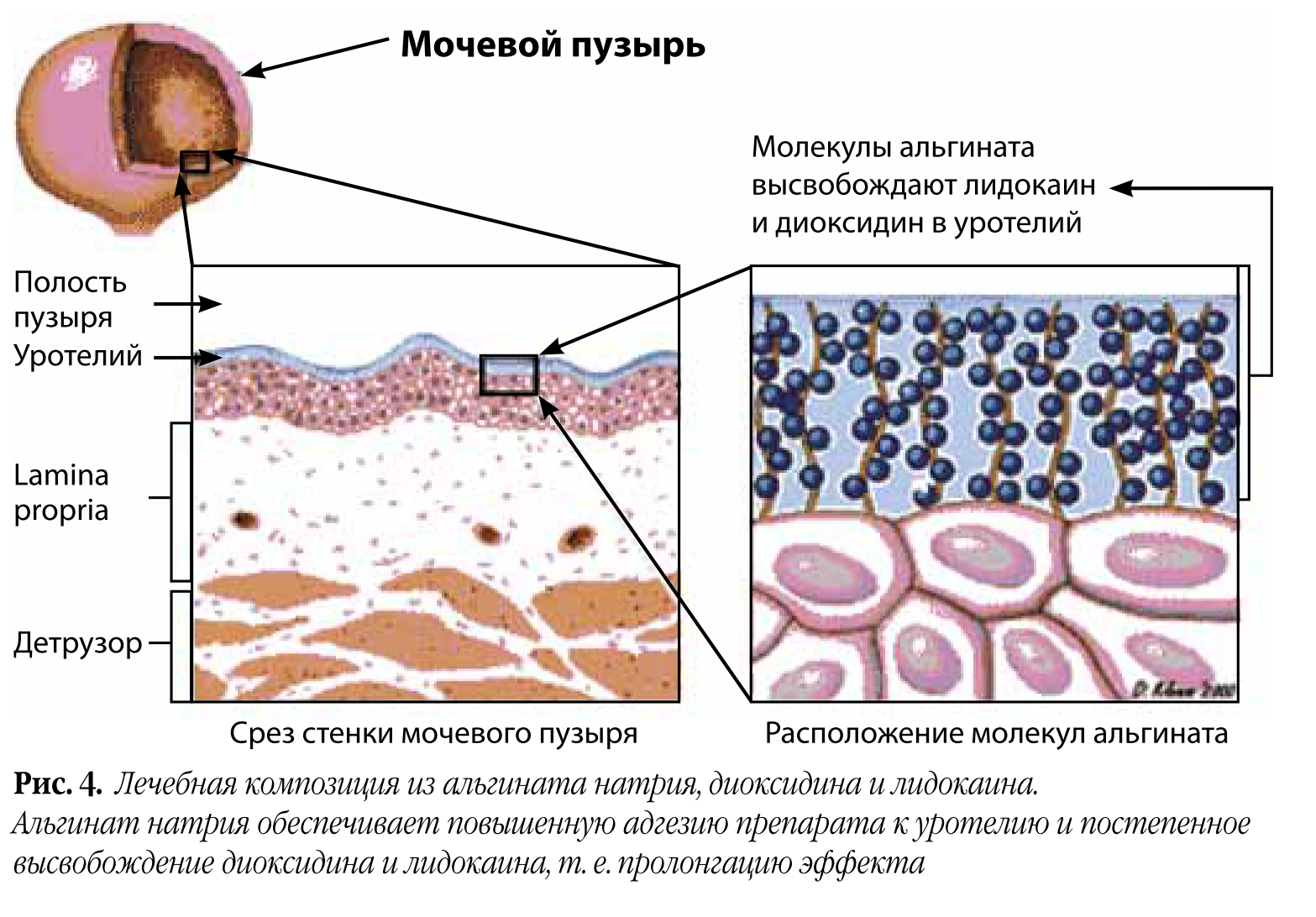
Первый этап – антибактериальная и симптоматическая терапия. Для этого мы выбрали комбинацию антибактериального препарата широкого спектра действия диоксидина и анестетика лидокаина. Для усиления адгезии к уротелию мы использовали альгинат натрия (рис. 4). Этот полисахарид обеспечивает длительное действие диоксидина и лидокаина.
Был проведен эксперимент in vitro по сравнению степени адгезии к коллагеновой мембране раствора гиалуроната натрия и комбинации гиалуроната натрия с альгинатом натрия. Степень адгезии композиции с альгинатом была соответственно в 8 раз выше, продолжительность действия также была больше. Таким образом, симптомы (боль и поллакиурия) исчезали через несколько минут после введения. Длительность действия составила от 24 до 48 ч.
Данная композиция (диоксидин, лидокаин, альгинат натрия) зарегистрирована под названием Колетекс-АДЛ. В урологии применяется под торговой маркой УРОЛАЙН-АДЛ (шприцы объемом 20 мл.).
Что касается усиления диффузии в уротелий – этого можно добиться использованием димексида (ДМСО).
Поскольку в различных клинических ситуациях возможно использование различных методик, было решено не добавлять димексид в Колетекс-АДЛ, а создать отдельную композицию на основе димексида и альгината натрия (Колетекс-Д/УРОЛАЙН-Д). При необходимости во время инстилляции можно через тот же катетер ввести димексид.
Второй этап – репаративная и иммунокоррегирующая терапия. Для этого принято решение использовать комбинацию дерината и альгината натрия, так как деринат обладает следующим комплексом свойств.
В качестве иммуномодулятора:
- модулирует активность фагоцитов и прежде всего макрофагов;
- нормализует показатели клеточного иммунитета;
- нормализует показатели гуморального иммунитета.
В качестве репаранта и цитопротектора:
- предупреждает альтерацию, связанную со свободно-радикальным повреждением клеток;
- проявляет антиоксидантные и мембраностабилизирующие свойства;
- обладает высокой репаративной и регенераторной способностью. Для увеличения адгезионных свойств раствора также был применен альгинат натрия. Данный препарат зарегистрирован под названием Колетекс-ДНК/УРОЛАЙН-ДНК.
Третий этап – восстановление гликозаминогликанового слоя уротелия. Основным компонентом гликозаминогликанового слоя является гиалуроновая кислота (УРО-ГИАЛ (гиалуронат натрия)).
Таким образом, трехэтапная внутрипузырная терапия хронического бактериального цистита с использованием альгината натрия для усиления адгезии и пролонгации действия, димексида или внутрипузырного электрофореза с целью увеличения диффузии препаратов в уротелий, является перспективным способом лечения этой патологии. Необходимо проведение дополнительных исследований, оценивающих ее эффективность и безопасность.








